- INTRODUCCIÓN.
- EL IODO.
- SÍNTESIS DE LAS HORMONAS TIROIDEAS.
- ALMACENAMIENTO DE LAS HORMONAS TIROIDEAS.
- LIBERACIÓN DE LAS HORMONAS.
- AGENTES ANTITIROIDEOS.
La función fisiológica fundamental de esta glándula es la síntesis de la hormona tiroidea en cantidad necesaria para satisfacer la demanda de los tejidos periféricos. El Ti produce dos hormonas, L-thiroxina (tetraiodotiroxina) o T4 y L-triyodothironina o T3. La producción de estas hormonas es el resultado final de una completa serie de vías y mecanismos de retroalimentación relacionados con el ejem hipotálamo-hipófiso-tiroideo. La materia prima fundamental para la síntesis de estas hormonas es el I y estas son las únicas hormonas que necesitan un oligoelemento para su síntesis. El 65% del peso de la T4 es yodo.
Por tanto, la síntesis normal de hormonas tiroideas requiere:
- una glándula desarrollada normalmente;
- un aporte nutricional de iodo adecuado;
- un perfecto funcionamiento de una serie de complejas reacciones bioquímicas secuenciales, procesos controlados por mecanismos de regulación positiva y negativa desde el nivel hipotálamo-hipofisario.
Los pasos de la síntesis hormona que a continuación iremos explicando se pueden resumir como los siguientes:
- El yodo ingerido en la alimentación se absorbe en el intestino delgado y pasa a la circulación plasmática en forma yoduro (sal inorgánica, o ión I) hasta llegar a la glándula.
- Por simple difusión desde el plasma el I pasa al interior de la GT impulsado por la diferencia de concentración plasma/glándula. En el interior de la glándula el yoduro es transportado al interior del tirocito por una proteína transportadora de membrana específica situada a nivel de la membrana basal del mismo denominada NIS (del inglés, Na/I symporter).
- Dentro del tirocito el yoduro intracelular migra desde la membrana basal por la que ha penetrado en la cc hacia la membrana apical.
- Dentro del tirocito el retículo endoplásmico sintetiza dos proteínas clave en la síntesis hormonal: la enzima tiroperoxidasa y la proteína tiroglobulina. Debido a que la concentración de yodo en el plasma es muy baja, se precisa que la cc tiroidea disponga de proteínas para concentrar las cantidades necesarias de este elemento.
- La tiroperoxidasa se sitúa en la membrana apical donde reduce el H2O2, oxidando el yoduro a una especie de yodante o yodonio. El H2O2 es generado por la coenzima nicotinamida dinucleótido fosfato y el calcio. Los fármacos antitiroideos actúan interfiriendo en la oxidación del yoduro.
- El yodonio se une a los tirosilos de la tiroglobulina. La tiroglobulina es una glucoproteína cuyos radicales tirosilos sirven de sustrato para la yodación al incorporarse el yodo a los mismos.
- De la unión Tg y yodonio se forman dos yodotirosinas que son hormonas inactivas que son la monoyodotirosina (MIT) y diyodotirosina (DIT).
- Cuando el cuerpo necesita hormona tiroidea, la Tg pasa de nuevo del coloide al tirocito y es digerida por proteasas endosomolares. La MIT y la DIT se desligan de la Tg pierden el I y se forman las hormonas activas T4 y T3.
- Para formar la T4 y T3, la monoyodotirosina se une con un nuevo yodo en posición 5 para formar diyodotirosina. Las moléculas de DIT y MIT se unen entre si mediante un proceso denominado reacción de acoplamiento para producir T4.
- Finalmente a través de la membranabasal del tirocito las hormas activas pasan al torrente circulatorio.
El yodo constituye un componente fundamental de la estructura molecular de las hormonas tiroideas. En el reino animal adquiere una importancia excepcional al formar parte de estas hormonas.
Se puede denominar yodo o iodo indistintamente, es un elemento químico de número atómico 53 situado en el grupo de los halógenos (grupo 17) de la tabla periódica de los elementos. Su símbolo es I. Forma parte de sales inorgánicas: yoduro sódico; yoduro potásico; yoduro sódico-potásico; yodatos.
El término yodo puede ocasionar confusión, ya que se puede referir al átomo yodo o al yodo molecular. Cuando nos referimos al yodo lo estamos haciendo al elemento en general y cuando nos referimos a yoduro nos referimos específicamente al ión I. En este capítulo se describe la disponibilidad de I, su absorción, la captación por el Ti, su oxidación e incorporación a las hormonas tiroideas.
El yodo ingerido se absorbe a través del intestino delgado y se transporta en el plasma hasta la Ti, donde se concentra, se oxida y se incorpora a la Tg para formar MIT y DIT y, posteriormente estas se desligan del mismo al formar T4 y T3.
El yodo es un componente indispensable para la síntesis de las hormonas tiroideas, comprendiendo 65% del peso de la T4, y el 58% del de la T3. Su exceso o insuficiencia impide una síntesis hormonal adecuada.
La formación de cantidades normales de hormona tiroidea precisa de I como componente fundamental de la misma y para ellos es necesario, primero que haya una disponibilidad de yodo exógeno a la glándula en cantidad adecuada para que los niveles plasmáticos del mismo permitan su entrada por difusión en la glándula; en segundo lugar es necesario, que una vez dentro de la glándula, se realice su captación por parte del tirocito.
La fuente más importante de yoduro que tiene el organismo es la nutricional: el agua bebida y los alimentos. La leche, carne, contrastes iodados y antisépticos iodados (betadine) son fuente importantes de I.
El aporte atmosférico es muy inferior al alimentario siendo mayor su concentración en el aire marino que en el continental. Esto es debido a que como el agua marina es rica en yodo (50-60mcg/L) el aire que toma la evaporacion del mar en las zonas costeras, también es más rica en iodo. Por contra, escasea “tierra adentro”, sobre todo en lugares circundados por cadenas montañosas que obstaculizan la llegada de aire cargado de yodo proveniente del mar. Esta situación fue detectada en las Hurdes extremeñas, en ciertas comarcas de Asturias, en el entorno de los Alpes (Suiza) y otras muchas zonas de Europa. También hay escasez de yodo en Mesoamérica y Sudamérica: cordilleras andina y aledañas de Perú, Ecuador, Bolivia, Argentina y Paraguay. Lo mismo ocurre en gran parte de Asia Central, etc., donde la carencia endémica de yodo se manifiesta por la incidencia de “bocio” en un alto porcentaje de sus pobladores; además del aire también el agua potable y las cosechas de vegetales nacidas en sus suelos son deficientes en yodo.
La toma diaria de I en el adulto varía, desde 10 µg en las zonas de extrema deficiencia, hasta varios cientos de µg en las personas que lo toman medicinalmente. La toma promedio se calcula, en un adulto normalmente alimentado, en 100-150 µg/día, considerando que esta cantidad es el requerimiento ideal de I para evitar deficiencias. La ingestión escasa de yodo fuerza a la GT a captar al máximo este mineral, motivando una hiperplasia glandular desencadenante de bocio. Así está comunicado que la ingesta de menos de 50 mcg diarios de yodo consitituye un riesgo de aparición de bocio. Y que con un aporte inferior a 25 mcg diarios de yodo, el bocio alcanza gran tamaño, acompañándose de cretinismo.
Se han utilizado diferentes suplementos alimenticios para el aporte de I en la dieta: compuesto iodados en la industria del pan y en la esterilización de la leche. Cuando se comenzó el uso del yodato (sal del ácido iódico) como acondicionador del pan en la industria panadera mejoró mucho el aporte dietético de yodo; este aditivo ha sido sustituido más recientemente por otros acondicionadores que no contienen yodo. También se utilizan en la industria láctea los yodóforos como agentes esterilizantes, aprovechando el poder germicida del yodo, lo hace que se aporte mucho yodo a la cadena alimentaria, pero esta fuente de aporte también está disminuyendo. La recomendación de utilizar sal yodada al cocinar es una buena medida para evitar déficit alimentario de I. La sal yodada (45-75 mg/Kg) como fuente de yodo acabó con el cretinismo endémico en Suiza, donde se comenzó a utilizar en 1922. En Estados Unidos la yodación de la sal se inició en 1924, con muy buenos resultados. En España, desde 1983 la Administración aceptó la necesidad de legislar la normativa para la yodación de la sal de consumo humano (60 mg/Kg), pero no es obligatoria ni exclusiva su utilización, es voluntaria y depende de las campañas promovidas por Salud Pública.
La población en general no es consciente del I que toma en su alimentación ya que en el etiquetado de los productos alimenticios no se informa de la cantidad de I que contienen, por lo que deben de ser las autoridades sanitarias quien lo vigilen. El sistema que se utiliza para conocer los niveles de I en la población es su determinación en orina. Así p.e. en Canadá en 1975 se observó una media de excreción de I muy pobre, lo que determinó que las autoridades sanitarias promulgasen una normativa sobre el I que debería contener la sal de consumo.
Como todos estos aportes externos pueden ser muy irregulares, el Ti tiene, entre otras funciones, la de almacenar I, con objeto de asegurar una autonomía de aproximadamente cien días.
Actualmente, además de disponer de los alimentos transcritos en la tabla que mas abajo se puede observar y de otros no mencionados, se cuenta con diversas formas farmacéuticas dispensables que contienen yodo: tabletas de yoduro potásico a concentraciones de 100 - 300 mcg; preparados farmacéuticos polivitamínicos con múltiples minerales y oligoelementos; aceite vegetal yodado con 480 mg de yodo por ml; solamente, la toma de 1 ml de este preparado provee de yodo a la persona por un año. Cuando se precisa aportar I, se ha de saber que existen medicamentos que proporcionan cantidades mucho mayores que una dieta normal, p.e. 200 mg del antiarrítmico amiodarona proporcionan 75 mg de I.
La ingesta máxima permitida no debe rebasar los 900-1.000 mcg diarios de yodo. Tanto la deficiencia como el exceso de I no son buenos. Un exceso de I puede inducir al hipertiroidismo, enfermedades autoinmunes del Ti y del Ca. Un déficit puede producir retraso mental, bocio, hipotiroidismo y todo un conjunto de enfermedades desencadenadas por deficiencia de I.
ALGUNOS DE LOS APORTES DE I EN LA DIETA.
µg en una dieta normal
|
Productos de lechería |
52 |
|
Granos |
78 |
|
Carne |
31 |
|
Platos mezclados |
26 |
|
Vegetales |
20 |
|
Postres |
20 |
|
vos |
10 |
|
Sal iodada |
380 |
|
Otro |
|
|
Mineral/de vitamina prep (por tableta) |
150 |
|
Amiodarone (por tableta) |
75,000 |
|
Povidona yodada (por ml) |
10,000 |
|
Ipodate (por capsula) |
308,000 |
Antes de ser absorbido a través de la pared del intestino delgado, el yodo es transformado en la sal yoduro (ion negativo del I) al unirse con un radical simple o compuesto; los iodopéptidos de cadena corta como la T4 y la T3 y los yoduros de los contrastes iodados son absorbidos intactos.
La concentración normal de I en el plasma es de 1 µg/dl.
El I es absorbido por el enterocito de la pared intestinal mediante un proceso de transporte activo y desde éste pasa mayoritariamente al espacio extracelular. Normalmente se absorbe entre el 50-60% del yodo ingerido, estando el grado de absorción en relación inversa con la cuantía de su aporte. La absorción se incrementa durante el embarazo y la lactancia. La GT capta la mayor la mayor parte del I de este espacio y lo concentra. Una pequeña parte puede ser captada por las glándulas salivales, gástricas e intestinales, así como por ovario, placenta, coroides, hematíes y huesos.
Otra parte del I extracelular es aclarado por otros órganos:
- El exceso I extracelular es enseguida filtrado por los riñones para su eliminación por la orina. El aclaramiento renal de I es de 30-50 ml plasma/minuto. El filtrado glomerular del I se realiza de forma pasiva en función del nivel sanguíneo del mismo. En condiciones fisiológicas, la medición del I excretado por la orina constituye un marcador - guía para el aporte dietético de este oligoelemento. La situación de normalidad es una excreción urinaria de yodo > 50 mcg/g de creatinina.
Mediante este mecanismo sólo en circunstancias anormales puede haber una importante pérdida de I como ocurre en el síndrome nefrótico, circunstancia en que se elimina por orina hormonas tiroideas unidas a sus proteínas transportadoras; en el hombre el aclaramiento de I depende fundamentalmente de la filtración glomerular. El aclaramiento renal del I puede aumentar en el hipertiroidismo y disminuir en el hipo pero en ambos casos las variaciones son pequeñas. Con una dieta de 150 µg/día el aclaramiento renal de I es de 10-25 ml/minuto. El aclaramiento en humanos es de 40-60ml/min lo que supone un descenso de I en el plasma del 12%. El aclaramiento tiroideo de yodo puede alcanzar 100ml/mn en casos de deficiencia de I, o llegar a 3-4 ml/min tras la ingestión de I crónico de 500-600 µg/dia.
- Las glándulas salivares y gástricas también pueden aclarar y concentrar I, aunque en menor grado que el Ti.
- En cantidades muy pequeñas se detecta I en el sudor y en el aire expirado.
- La leche materna tiene importantes cantidades de ioduro sobre todo durante las primeras 24 h. Tras su ingestión, su contenido es proporcional al I de la dieta materna. La leche materna es la fuente virtual de todo el I para el recién nacido por lo que si es sustituida por otras leches es necesario que estas proporcionen cantidades adecuadas de I.
El I puede administrarse mediante diversas formas farmacéuticas: tabletas de yoduro potásico a concentraciones de 100 - 300 mcg; preparados farmacéuticos polivitamínicos con múltiples minerales y oligoelementos; aceite vegetal yodado con 480 mg de yodo por ml; solamente, la toma de 1 ml de este preparado provee de yodo a la persona por un año.
Al administrar suplementos de I se ha de tener en cuenta que:
Además del procedente del exterior, el Ti consigue también I recuperando parcialmente el procedente de la desyodación de las hormonas tiroideas en los tejidos periféricos.
Durante el embarazo aumenta la actividad tiroidea por lo que el embarazo en sí induce a una situación de déficit iódico. Aumenta la prodcción de Tg con lo que aumenta las tasas de hormona sanguínea.
Los suplementos de yodo podrían interactuar con los medicamentos antitiroideos como el metimazol, utilizado para el tratamiento del hipertiroidismo. Ingerir dosis elevadas de yodo con medicamentos antitiroideos podría provocar que el cuerpo produzca una cantidad muy escasa de hormonas tiroideas.
Consumir yoduro de potasio con medicamentos antihipertensivos IECA (inhibidores de la enzima conversora de la angiotensina), podría aumentar la cantidad de K en la sangre a niveles peligrosos. Lo mismo ocurre con mayor intensidad si se consume yoduro de potasio con diuréticos ahorradores de potasio, tales como la espironolactona (Aldactone®) y amilorida (Midamor®).
Otras causas de déficit de I pueden ser el déficit familiar de deshialogenasa tiroidea, el síndrome de malabsorción intestinal, la lactancia o por acción de algunos alimentos como la soja.
En poblaciones con déficit de yodo, se han observado cambios histopatológicos después de una ingesta de yodo suplementario con una mayor prevalencia de cánceres papilares o cánceres foliculares.
Captación del I por el tiroides.
El yodo que la glándula va a utilizar en la síntesis de hormona lo extrae:
- Del yoduro inorgánico que hay en el líquido extracelular tras haber sido absorbido por el intestino.
- Dentro de la propia glándula del I procedente de la hidrólisis de la Tg, como luego veremos.
La GT capta un 20% del yoduro plasmático cada vez que este perfunde la glándula. Dentro del Ti hay una concentración de yoduro 20-50 veces superior a la del plasma dependiendo de la cantidad de I disponible en el plasma y de la actividad de la glándula. Esta concentración puede ser superior 100:1 en tiroides hiperactivos como p.e. en la enfermedad de Graves.
El trasporte de yoduro plasmático al interior de la cc folicular se realiza mediante una proteína cotransportadora (NIS) de Na/yoduro y requiere un proceso energético que precisa de O2.
La ouabaina (acocanterina), digoxina y otros glucósidos cardíacos bloquean in vitro la absorción de I, pero el K puede contrarrestar esta inhibición lo que demuestra que el transporte-absorción de I por la glándula depende de un nivel de K adecuado en el interior de la celda tiroidea y está en íntima relación con la ATPasa de la membrana. Cuando se produce una hiperplasia de la glándula la absorción del I varia de acuerdo con la actividad de la bomba Na-K y la actividad de la ATPasa.
El Ti es además capaz de concentrar otros iones como el bromuro, astato, pertecnetato, rhenate y clorato, pero no fluoruro.
NIS.
Como hemos dicho, el transporte del I al interior del tirocito es el primer paso de la síntesis hormonal y se realiza mediante una glucoproteína a través de la membrana plasmática basal del tirocito. Esta gñucoproteína se denomina transportador de I, o NIS (del inglés, Na/I symporter), antiguamente llamada bomba de yoduro. Esta proteína cataliza el trasporte activo de yoduro al interior de la GT y también en menor cantidad a otras glándulas (salivares, estómago, glándula mamaria, etc) y tejidos. Esto lo realiza en contra del gradiente electroquímico del I: realiza el acoplamiento para la translocación de sodio hacia el interior del tirocito (a favor de su gradiente electroquímico) y a la vez la translocación de yoduro también hacia el interior de la cc (pero en contra de su gradiente electroquímico). NIS transporta yoduro inorgánico junto con 2 átomos de sodio (CNa2I) de forma activa al interior de la cc a través de su membrana basolateral.
El NIS hace que el I pase a la glándula más rápidamente que lo haría por simple difusión, realizando un mecanismo de transporte-concentración como es el que se realiza para el sodio (hacia afuera) y para el potasio (hacia adentro) en contra de sus gradientes electroquímicos. La energía necesaria para este fenómeno es provista por la actividad de la bomba Na+ /K+ adenosina trifosfatasa (Na+ /K+ ATPasa) que desplaza al sodio (hacia afuera) y al potasio (hacia adentro) en contra de sus gradientes electroquímicos.
La afinidad del NIS por el I es muy superior a la que tiene para otros aniones inorgánicos como el cloruro o el bromuro.
El código genético del NIS en humanos es muy similar al de algunos animales. Igualmente parece tener alguna similitud con la TPO (peroxidasa tiroidea), así como con proteínas de ciertas bacterias y virus, este parecido puede tener algo que ver con la posible etiología infecciosa de las enfermedades tiroideas autoinmunes, además se han identificado 11 mutaciones del mismo.
La TSH estimula al gen de la NIS y así estimula su función de transporte que es además modulada por citoquinas como el TNF o el TGF-1. Mutaciones en el gen de la NIS producen un defecto en el transporte de I al interior de la glándula y como consecuencia bocio. Cada vez se están comunicando más mutaciones de este gen descubiertas como responsable de un bocio.
Otros tejidos que son también capaces de concentrar I presentan igualmente en la membrana de sus cc NIS, como la mama o el ovario.
Se ha observado un aumento de NIS en la enfermedad de Graves y en los nódulos tiroideos hiperplásicos.
Se ha observado una disminución del NIS en la tiroiditis autoinmune, en el carcinoma de Ti y en los nódulos fríos, lo que explica su pobre captación de I. En ausencia de este mecanismo transportador o bloqueo del mismo se producirá bocio e hipotiroidismo. Como a lo largo de este tema veremos estas situaciones se pueden producir como consecuencia de una enfermedad o por la administración de fármacos y la situación puede ser corregida mediante la administración de I siempre que con la cantidad administrada se consiga alcanzar un nivel plasmático del mismo tan grande que éste entre en la glándula por simple difusión.
Un gen situado en el cromosoma 19p controla este transporte a través de la proteína de transcripción del tiroides(TTF-I) que regula la transcripción de genes específicos del Ti.
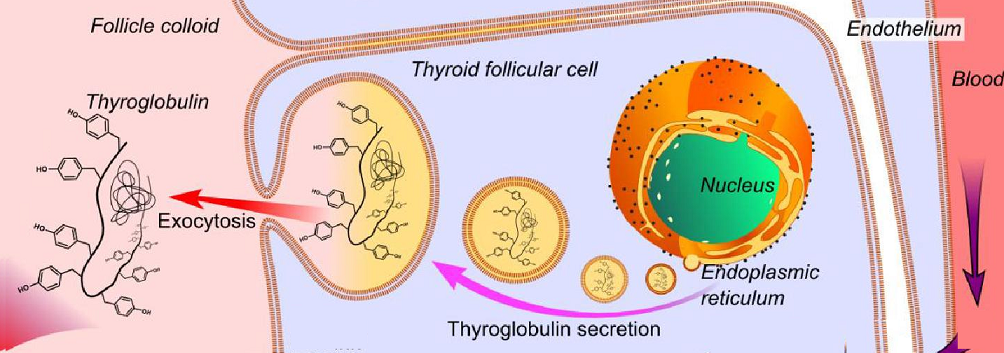
Tiroglobulina.
La tiroglobulina es una glucoproteína de cien radicales tirosilos presente en los folículos tiroideos. Es sintetizada bajo el estímulo de la tirotropina en el retículo endoplásmico de las cc foliculares de la GT siendo sus funciones:
- La principal es proporcionar la estructura peptídica para la síntesis y el almacenamiento de las hormonas tiroideas.
- Tras absorber el yoduro el Ti rápidamente lo oxida a I por acción de la TPO y lo une a la proteína Tg.
- Constituye un depósito conveniente para el almacenamiento y la recuperación de yodo cuando la disponibilidad externa de yodo es escasa o irregular.
- Lanza a la circulación las hormonas tiroideas.
El retículo endoplásmico rugoso del tirocito sintetiza la cadena polipeptídica de la Tg que contiene en su estructura más de 100 residuos del aminoácido tirosina. A esta estructura se añaden carbohidratos sintetizados en el aparato de Golgi que la glicosida.
La glicosilación es un fenómeno clave en la maduración de la Tg. Los hidratos de carbono constituyen aproximadamente el 10% del peso de la Tg. La Tg humana puede contener cuatro tipos diferentes de unidades de carbohidratos.
La Tg es secretada al citoplasma en el interior del tirocito y empaquetada en microvesículas que emigran a la parte apical del tirocito hasta fundirse con la membrana apical para ser yodada y mediante una exocitosis, pasar al lumen folicular donde es almacenada. La microvesículas portadoras de Tg son también transportadoras de TPO.
La Tg también contiene azufre y fósforo. El primero está presente en el condroitín sulfato y en las unidades de hidratos de carbono complejos, aunque se desconoce su forma y función.
Tiroperoxidasa: TPO.
Como hemos dicho las vesículas portadoras de Tg son también portadoras de TPO. Cuando la vesícula que transporta la Tg se funde con la membrana apical, la enzima queda libre en la membrana apical y va a realizar su función que es catalizar la oxidación del yoduro a I para iodar los residuos de tiroxina dela Tg.
Para que la TPO oxide el I es necesario H2O2. Por tanto, es necesario un sistema generador de H2O2 para elevar el yoduro al estado de oxidación necesario. Recordar que una peroxidasa requiere de H2O2 para su función oxidativa. El H2O2 se genera en la membrana apical de las cc tiroideas por la acción de dos enzimas denominadas dual oxidasas 1 y 2, también se denominan oxidasas tiroideas, Estas para su activación requieren Ca++ y la coenzima NADPH. Existen varias teorías de como se realiza la esta oxidación pero está claro que el yoduro es oxidado por el H2O2 y la TPO, para una vez oxidado ser transferido a los grupos tirosilo de la Tg.
La TPO es estimulada por la TSH. La TSH también estimula la actividad de la NADPH oxidasa y por tanto la producción de H2O2.
Una reducción congénita de esta peroxidasa produce bocio congénito en niños. En las enfermedades tiroideas autoinmunes se han podido diferenciar Ag microsomales contra la TPO y se ha detectado la formación de Ac contra dichos Ag.
Tras un periodo variable de almacenamiento en el coloide, las Tg se reabsorben por la cc folicular y dentro de la cc los enlaces peptídicos de aminoácido tiroxina se escinden para ser yodadas dando lugar a la MIT y a la DIT.
El yoduro, una vez incorporado a la glándula, ha de pasar por una serie de reacciones hasta ser incorporado a las hormonas tiroideas activas.

Transporte y oxidación del I.
El yodo, una vez en el interior de la cc, pasa por la membrana apical al coloide mediante una proteína transportadora antiporter denominada pendrina y posiblemente también mediante otros transportadores que aún no se conocen. La pendrina es una proteína de 780 aminoácidos transportadora de aniones que en el Ti transporta Cloruro/yodo a través de la membrana apical al coloide, mete cloro a la cc y saca I; Pendred ha descrito un síndrome congénito producido por una mutación en la misma que consiste en una hipoacusia neurosensorial, dilatación del vestíbulo y bocio por un defecto en la iodación.
Además de la pendrina, se ha identificado un tercer transportador proteico, denominado “Transportador Apical de Yoduro”. Esta proteína también transporta ácidos grasos de cadena corta, pero la relación entre los ácidos grasos y el transporte apical de yoduro todavía no está aclarada.
El yoduro intracelular es transportado por la pendrina para ser oxidado transformándose el yoduro en yodante o yodo orgánico. Esta oxidación es realizada por la enzima TPO y está regulada por la TSH. El I orgánico o yodante a continuación se fija a la Tg, si bien una pequeña porción queda libre pero que supone menos del 1% del I total del I intratiroideo.
Esta reacción de oxidación se realiza a un ritmo del 50-100% por minuto el I intracelular. La proporción de I transformado es muy estable, es decir, que varia poco con respecto a la ingesta diaria, por el contrario, la actividad de la NIS es muy sensible tanto en lo que respecta a la disponibilidad de I como a su estimulación por la TSH.
Esta reacción puede ser inhibida por fármacos o puede estar más o menos alterada en algunas enfermedades y en estos casos se puede producir bocio e hipotiroidismo.
Fijación del I a la tiroglobulina.
El paso siguiente a la oxidación es la fijación del yodo orgánico a la Tg, es decir, la yodación de la Tg.
El yodo orgánico (yodotirosilo) se fija a la Tg mediante una unión covalente a los residuos de tirosilo en la Tg para producir MIT y DIT (monoyodo y diyodotirosina). Esta reacción se produce en el polo apical (polo coloide) del tirocito, en su membrana celular apical, y está catalizada también por la TPO, como lo estaba la oxidación del I. La molécula de Tg es un dímero de dos cadenas idénticas y alrededor de un tercio de los residuos de tirosilo de la molécula es objeto de yodación.
Este proceso de incorporacion de yodo a la Tg para transformarla en las dos tirosinas precisa de H2O2, yodante, TPO y Tg glicosilada.
Las tirosinas formadas, MIT y DIT son hormonalmente inactivas y segregadas al coloide.
Almacenamiento.
La tiroides es la única glándula endocrina que almacena grandes cantidades de hormonas. Este aspecto tiene gran importancia en la homeostasis hormonal, ya que provee una gran protección contra la carencia hormonal en el caso de que la síntesis se encuentre interrumpida.
La Tg yodada es el principal contenido del coloide y es la forma de almacenar las hormonas precursoras de las hormas activas.
La Tg normalmente no pasa a la sangre pero en circunstancias anómalas pueden observarse en sangre pequeñas cantidades de tiroglobulina: embarazo, bocio simple, hipertiroidismo, tumores diferenciados.
El Ti posee la capacidad de almacenar una gran cantidad de Tg en el coloide y de ir utilizándola a a un ritmo muy lento, por eso ocurre que la administración de fármacos antitiroideos no produce su efecto hasta después de dos semanas.
Tras un periodo variable de almacenamiento en los folículos tiroideos, cuando la glándula precisa sintetizar hormona, las gotículas de coloide ricas en Tg pasan por endocitosis al interior de las cc foliculares donde la Tg sufrirá los efectos de una reacción de proteolisis. Este proceso cursa tras la fusión entre las vesículas que albergan el coloide y las membranas de lisosomas ricos en proteasas que catalizan la hidrólisis de la tiroglobulina. Este proceso de digestión es estimulado por la TSH. La Tg es digerida por proteasas endosomolares, particularmente las endopeptidasas catepsinas B, L, D, y exopeptidasas, incluyendo la dipeptidsa lisosomal I y otras. La MIT y DIT pierden el yodo por la acción de la enzima desyodasa de yodotirosina microsómica, también denominada yodo tirosina deshalogenasa 1.
En el interior de la cc tras la proteolisis de la Tg se produce una reacción denominada de acoplamiento: consiste en la unión de pares de moléculas de yodotirosina, dos moléculas de diyodotirosina se unen para formar la T4, y una molécula de monoyodotirosina se une a otra de diyodotirosina para constituir la T3. Esta reacción de acoplamiento esta estimulada por la TSH y frenada por la tasa de T4. La Tg al proteolizarse da lugar a la T4, T3 hormonas activas.
Tras la digestión de la tiroglobulina, las hormonas T3 y la T4 son liberadas al plasma a través de los capilares fenestrados perifoliculares.
El yodo no hormomal, que supone alrededor del 70% del yodo de la tiroglobulina es recuperado intratiroideamente por una yodotirosina deiodinasa y queda disponible para su reciclaje dentro de la glándula.
¿Que ocurre con el I en la reacción de acoplamiento? . El 0.5% del peso de cada molécula de tiroglobulina es I y equivaldría aproximadamente al I de tres moléculas de T4 y una molécula de T3. Por eso la mayor parte del I libre intratiroideo proviene de las desiodización de monoyodotirosina (MIT) y diyodotirosina (DIT), este I libre es reciclado dentro del Ti o excretado al torrente circulatorio. El tiroides es el mayor pool orgánico de yodo con unos 8.000 microgramos y su recambio es lentísimo a un ritmo de 1% día.
La T4 es la hormona que se produce en mayor cantidad dentro de la glándula, la T3 se forma en muy poca cantidad dentro de la misma (20%); la mayor parte de T3, el 80%, se forma en los tejidos periféricos y proviene de la desyodación de la T4 (monoyodasa).
La T3, es una hormona más activa que la T4, incluso hay quien cuestiona si la T4 tiene alguna actividad en los tejidos. La T4 produce en los tejidos periféricos T3 mediante la acción de una yodotironina desyodasa que elimina un yodo de la T4 en posición 5´. Sólo la hormona libre es biologicamente activa y está disponible para os tejidos.
A lo largo de la vida la tasa de T4 es inmutable pero la de T3 va decreciendo desde la edad media hasta la vejez debido a una menor reconversión periférica.
Solo la hormona libre es biologicamente activa
Transporte.
Ambas hormonas T3 y T4 son segregadas por el tirocito bajo el estímulo de la tirotropina y pasan a la circulación para unirse firmemente a diferentes proteínas transportadoras:
- La TBG (globulina fijadora de tiroxina: tiroxin-binding globulin) es la proteína transportadora más importante, que además se puede ligar a ambas, T3 y T4. Diversos factores pueden influir en las concentraciones de TBG: medicamentos, gestación, estado nutricional y algunas enfermedades sistémicas. Cuando la concentración de TBG esta baja también baja la disponibilidad de hormona hasta que los mecanismos homeostáticos del eje hipofisario lo corrigen.
- La transtiretina (TRR) o prealbúmina fijadora de tiroxina (TBPA), sirve de transporte a la T4, aunque siempre en una menor proporción que la TBG.
- La albumina del suero.
- Otras lipoproteinas del suero: su contribución al transporte total de la hormona es insignificante en situaciones fisiológicas y patológicas.
La TBG tiene mayor afinidad por la T4 que por la T3 y una afinidad por ambas 100 veces mayor que la que tiene la prealbúmina. Esta unión proteína-hormona puede estar inhibida por ciertos fármacos: fenitoina, tetraclorotironina, salicilatos, etc. Ambas proteínas transportadoras se fabrican en el hígado.
Además de las hormonas unidas a proteínas para su transporte, habrá en sangre también una pequeña parte de hormonas libres, siendo la proporción de las mismas 10 veces más de T3 que de T4, hormonas que llegarán a los tejidos para ejercer su función metabólica y luego ser degradadas, siendo la hormona ligada a proteínas un reservorio circulante inerte. En hombre normal, aproximadamente, el 0,03 % de la T4 del suero y el 0,3 % de la T3 están en forma libre.
Funciones de las proteínas transportadoras de las hormonas.
El efecto de la hormona tiroidea depende de la cantidad de hormona que llega a los tejidos y la disponibilidad de receptores inalterados y útiles de la hormona tiroidea en los núcleos de las células tisulares receptoras.
La cantidad de hormona contenida en el interior de la glándula, está en equilibrio con la cantidad de hormona libre en el suero. Analíticamente lo que podemos conocer es la concentración en el suero pero no la cantidad total de hormona, por lo que esta concentración en suero es generalmente un indicador bastante exacto del nivel de actividad de los procesos hormona-dependientes del tiroides.
Considerando la gran cantidad de hormona que es transportada en comparación con la libre, se deduce que las proteínas transportadoras suponen un depósito de hormona extratiroidea importante, de la cual solamente el 0,5 % por minuto es la fracción de hormona libre que está inmediatamente disponible para los tejidos. Se ha podido observar, que en ausencia de proteínas transportadoras la cantidad extratiroidea de T4 estará ostensiblemente reducida y en cuestión de horas incluso agotada totalmente, ya que en esta situación se produce el cese repentino de la secreción de la hormona. En contraste, cuando las concentraciones de proteínas transportadoras de hormonas son normales, si se produjese una parada de secreción hormonal durante 24 h acarrearía una disminución de la concentración de T4 y del T3 solamente del 10 y 40 %, respectivamente. Es por esto que se considera que otras de las funciones de las proteínas transportadoras es proteger al organismo de los efectos de fluctuaciones rápidas en la secreción hormonal que se pudiesen producir, por constituir, como hemos dicho, un reservorio circulante de hormona.
Otra función de las proteínas transportadoras de T4 es servir como protección contra las pérdidas de I, impartiendo características macromoleculares a las moléculas pequeñas de iodotironina, con lo que se reduce su pérdida urinaria La carencia de proteínas de alta afinidad a T4 en los peces, por ejemplo, se atribuye a la mayor abundancia del yodo en su habitat natural.
Los estudios de la perfusión del hígado sugieren otra función, que es facilitar una distribución celular uniforme de T4. Los estudios hepáticos han demostrado que los cambios en el nivel de hormona tiroidea circulante son comunicados rápidamente a todas las cc de los tejidos del organismo.
Por último tienen una función que realizan después de su unión a la globulina fijadora de corticoesteriodes, y es el control de la cantidad de hormona que sale.
Control de la hormona.
El eje hipotálamo-hipofisario-suprarrenal es un conjunto complejo de influencias directas e interacciones de retroalimentación entre tres componentes: el hipotálamo, la hipófisis y las suprarrenales. Los componentes esenciales del sistema regulador de la función tiroidea lo constituyen la hormona hipotalámica liberadora de tirotropina (TRH: thyrotopin- releasing hormone), la tirotropina u hormona hipofisaria estimulante del tiroides o tirotropina (TSH) y la triyodotironina (T3). La TRH y la TSH ejercen un efecto estimulador, mientras que la T3 ejerce un efecto inhibidor.
La TRH, hormona liberadora de tirotropina o tiroliberina estimula la síntesis y liberación de tirotropina por parte de las cc tirotropas de la hipófisis anterior.
En condiciones normales, los cambios en el nivel de hormona libre son corregidos por los mecanismos que rigen el estímulo o la supresión de la secreción, siendo el mecanismo principal para controlar este nivel la cantidad de hormona libre disponible que haya en cada momento. Las tasas elevadas de las mismas inhiben la secreción de tirotropina en las cc tirotropas, además antagonizan el efecto de la tirotropina mediante la regulación a la baja de los receptores de esta de las cc tirotropas. Las variaciones en las tasas de hormonas tiroideas producen cambios logarítmicos inversos en la secreción de tirotropina; este control es muy sensible de tal forma que variaciones mínimas de la hormona, incluso subclínicas, cambian el nivel de tirotropina. Esta es la base de la importancia que tienen los niveles de tirotropina en el diagnóstico de la patología tiroidea.
Otro mecanismo que rige el estímulo o la supresión de la secreción de hormona es la concentración de las proteínas transportadoras. La concentración total de la hormona en suero se mantiene normalmente en un nivel proporcional a la concentración de las proteínas transportadoras. El nivel de estas proteínas suele ser el adecuado para mantener un nivel constante de la hormona libre. La mayoría de las alteraciones de la concentración hormonal en suero dependientes de la proteína transportadora son debidos a cambios cuantitativos en las proteínas transportadoras y menos comúnmente a cambios en la afinidad para la hormona. Puesto que las fluctuaciones amplias en la concentración de las proteínas transportadoras de hormona tiroidea no alteran la economía hormonal o el estatus metabólico del sujeto, su función está abierta a la debate.
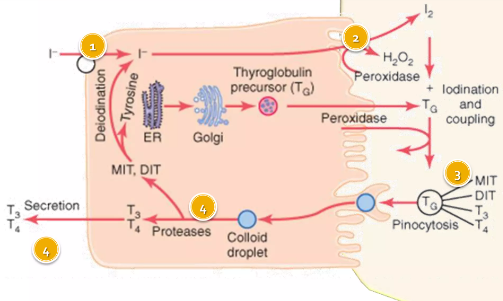
Para poder ejercer sus funciones sobre los tejidos diana distantes, las hormonas tiroideas deben desligarse de la Tg y pasar a la circulación de forma libre.
En circunstancias fisiológicas normales, este proceso comienza a producirse mediante la micropinocitosis del coloide para formar vesículas endocíticas contenido el mismo. El contenido de las vesiculas es procesado por los endosomas y luego por los lisosomas, separado la horma de la Tg siendo excretada la hormona activa a través de la membrana basal a la circulación capilar. La velocidad de este proceso está influenciada por la cantidad de Tg en el coloide y por la disponibilidad de vesículas endocíticas.
Los receptores apicales probablemente atraen algo de Tg que no va a sufrir la degradación lisosomal para su recirculación o transcitosis a la circulación. Las cc foliculares posee el receptor endocítico megalina, como todos epitelios de absorción, y esta se une a la región C-terminal de la Tg y actúa como mediador de la transcitosis, es decir el transporte de Tg madura de la superficie de la membrana apical a la basal, donde pasarían a la circulación sanguínea. Este fenómeno es estimulado por la TSH. Esto se propone como un mecanismo para prevenir la liberación excesiva de la hormona.
La reabsorción del coloide presenta un mecanismo que es controlado por la estimulación de la TSH. Los seudópodos de la membrana apical se extienden dentro del coloide y lo pellizcan para formar una gotita de coloide intracelular. Las gotitas de coloide son entonces rápidamente procesadas. Este es uno de los primeros efectos de la TSH en la glándula, tras varios minutos después su secreción.
Una vez de vuelta en la cc folicular en el interior de las gotitas, la Tg madura es descompuesta por enzimas digestivas en los endosomas y lisosomas. Tras la digestión de la Tg, la T4 y la T3 migran a la membrana basal, la atraviesan y entran en la circulación. Las hormonas son trasportadas a través de la membrana basal, por difusión y por la acción de los transportadores de membrana de monocarboxilato 8.
Alrededor del 70% del yodo de la Tg está en forma de DIT y MIT, por lo que representa una parte importante de la reserva de yodo de la Ti. En lugar de perderlo a la circulación, las moléculas de MIT y DIT pierden el I bajo la acción de la enzima yodotirosina desyodinasa (también denominada iodotirosina deshalogenasa) y devuelven la mayor parte del I al pool de yoduro intratiroideo residual.
Cada día se forma en el interior de la glándula entre 3 y 5 veces más yoduro por esta actividad deiodinasa que el que entra en la cc desde el suero. La importancia de este reciclaje interno del yoduro está confirmada por los sujetos con un tipo de hipotiroidismo congénitp debido a que no pueden deiodar las yodotyrosinas. Los efectos pueden invertirse mediante el tratamiento con grandes cantidades de yoduro.
Aún funcionando bien este mecanismo, parte del yodo de la glándula se pierde debido a la ineficacia de su reciclaje por la yodotirosina deiodinasa. Esta pérdida puede aumentar a medida que la Ti se adapta a una ingesta diaria elevada de yodo, posiblemente como un proceso autorregulador para evitar una yodación excesiva de Tg. Las glándulas enfermas pueden perder mucho más yoduro.
La GT además de las hormonas segrega otros productos filtrados: la Tg, la DIT, la T3 inversa (forma inactiva de T3) y la tiroalbúmina. La secreción de Tg es clínicamente importante. Su presencia en el suero puede detectarse mediante un análisis rutinario y proporciona un dato sensible, aunque inespecífico, de un aumento de la actividad y/o fuga tiroidea. Así, los niveles séricos son elevados en tiroides hiperplásicos y en muchos nódulos tiroideos y en el cáncer de tiroides diferenciado. La medición de Tg puede identificar el bocio hiperplásico congénito, el bocio endémico y muchos bocios multinodulares benignos, pero su mayor aplicación es en el seguimiento del cáncer diferenciado del Ti. La mayoría de los cánceres papilares y foliculares conservan parte de la función metabólica del tirocito normal, incluida la capacidad de producir y secretar Tg. Los sujetos con cáncer diferenciado de Ti tratados con cirugía y radioyodo no deben tener tejido tiroideo normal, y por lo tanto, no deben secretar Tg. Cualquier Tg que se encuentre en su suero probablemente refleja la presencia continua de tejido normal, improbable después de su ablación previa, o de cáncer de tiroides. El seguimiento de los niveles séricos de Tg es probablemente el medio más sensible y práctico para el seguimiento de estos pacientes. Es más sensible cuando se estimula al sujeto con TSH. Hasta hace poco, esto sólo podía hacerse mediante la retirada de la hormona tiroidea y el consiguiente hipotiroidismo sintomático, pero ahora se puede administrar TSH recombinante para aumentar la sensibilidad de la Tg sérica y la gammagrafía tiroidea.
La exposición al frío prolongado produce un aumento de la tasa de T4 a las 24 horas.
El ayuno prolongado, la desnutrición y la anorexia nerviosa producen un descenso de la T3, al haber una disminución de su producción periférica, recuperándose enseguida al realimentarse.
Síntesis periférica de T3.
De todas las hormas tiroideas la T3 es considerada como la hormona auténticamente eficaz, El 80% de la T3 se sintetiza periféricamente en órganos como el hígado, los riñones o el corazón a partir de la T4 mediante las enzimas deiodinasas que eliminan un yodo de la posición 5 de la tiroxina. Estas enzimas actúan a su vez sobre los metabolitos generados de la desyodación de T4 y T3, en una serie de desyodaciones secuenciales, hasta la obtención de la molécula de tironina, que carece de átomos de yodo.
La regulación de las hormonas tiroides se realiza, como hemos dicho al hablar del control hormona, además de por el eje hipotálamo-hipofisario-suprarrenal, mediante la conversión de tiroxina (T4) a tri-iodotinonina (T3) por las enzimas iodotironina deiodinasas, responsables mediante esta conversión de realizar un control homeostático, tanto plasmático como tisular, de las hormonas tiroideas. La T3 interactúa con el receptor nuclear de la cc tirotropa hipofisaria.
Hay tres tipos distintos de deiodinasas: tipo I, tipo II y tipo III. La distribución y regulación de estas enzimas puede tener efectos importantes sobre la acción de la hormona tiroidea.
La desyodasa 1: cataliza la conversión de T4 a T3, su principal función es la generación de las concentraciones de T3. La actividad de esta enzima es mayor en el hipertiroidismo y menor en el hipotiroidismo.
La deiodinasa tipo II tiene una alta afinidad por la T4 y se encuentra principalmente en la hipófisis, el cerebro y la grasa parda, donde convierte la T4 en T3 como mecanismo para modular la concentración local de T3.
La desyodasa tipo III: cataliza la desyodacion de T4 hasta T3 r (reversa). Se encuentra principalmente en tejidos como cerebro, piel, hígado, intestinos. La expresión de D3 es mayor en el tejido fetal y su actividad aumenta en el hipertiroidismo y disminuye en el hipotiroidismo.
Cada tejido posee unas concentraciones de triyodotironina procedente del plasma y de su producción local, la modulación de estas concentraciones depende del tipo de enzima desyodasa que posee cada tejido individualmente y la utiliza las desyodación local de acuerdo a los requerimientos que necesita de esta hormona.
La sobrealimentación, especialmente de carbohidratos, aumenta la tasa de T3.
Producen una disminución de T3, el stress, enfermedades febriles, infarto, diabetes, insuficiencia respiratoria, cetoacidosis.
Otra de las funciones de las desyodasas, es que al estar incluidas en la familia de las glutatión peroxidasas y tiorredoxin reductasas, proporcionan protección al tirocito frente a la toxicidad de un exceso de H2O2.
Existe un gran número de agentes químicos capaces de inhibir una o más reacciones necesarias para la síntesis hormonal, haciendo que aumente la secreción de TSH y como consecuencia aparición de bocio por lo que también se les denomina bociógenos:
- Inhibidores del transporte de yoduro: tiocinato y perclorato. ambos son muy efectivos pero por su toxicidad no se usan.
- Inhibidores de la organificación del yoduro y su acoplamiento: Tioniamidas, compuestos aminoheterocíclicos y fenoles o sus sustitutos (resorcinol y salicilamida). Los más potentes son las tionamidas: propiltiouracilo y metamizol.
- Inhibidores de la liberación de hormona: sales de litio.
- Son bociógenos ciertos alimentos: berza, nabo, coles, mostaza y mandioca.
- Los corticoides y el ACTH disminuyen la tasa de TSH.
Existen además otros factores que pueden afectar al eje hipotálamo-hipófisis-tiroides y que modifican la síntesis de tirotropina: la somatostatina y la dopamina son inhibidores fisiológicos de la secreción de TRH; los glucocorticoides disminuyen la sensibilidad de la TRH y los estrógenos la incrementan.
